Ake sú účinky CBD?

ENDOCANNABINOIDY
Psychoaktívne a bolesť tlmiace účinky rastliny konope (Cannabis sativa) sú človeku známe už tisícročia. Keď sa vedci začali zaoberať mechanizmom týchto účinkov, natrafili na celkom novú skupinu látok s vysoko vyvinutou a široko rozmiestnenou infraštruktúrou v našom tele, vrátane vlastnej výroby, ktoré preto nazvali ENDO-CANNABONOIDY (teda „vnútorné“ cannabinoidy) na rozdiel od cannabinoidov rastlinného pôvodu (PHYTO-CANNABINOIDY).
Tieto endocannabinoidy vyvíjajú svoje rozmanité účinky prevažne ako v krvi a tkanive obiehajúce takzvané ligandy väzbou na receptory sediace na povrchu cieľových buniek (princíp KĽÚČ-ZÁMOK).
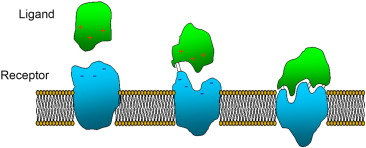
Najznámejšie a aj najlepšie preskúmané endocannabinoidy sú N-arachidonoylethanolamine (AEA, známy lepšie pod názvom anandamid, slovíčko pochádzajúce zo sanskritu ktoré znamená „šťastie, blaho“, prvý krát chemicky izolovaný a popísaný v roku 1992) a 2-arachidonoylglycerol (2-AG), celkovo sa jedná o viacero rôznych ale molekulárne podobne skladaných látok.
KEDY TELO PRODUKUJE ENDOCANNABINOIDY?
Endocannabinoidy telo vytvára vtedy, keď ich potrebuje a presne tam, kde ich potrebuje odstrihnutím a modifikáciou určitých častí mastných kyselín, z ktorých sa skladá stena bunky, účinok je teda prevažne priestorovo obmedzený na rozdiel od cannabinoidov vnesených do tela z vonka. Podnety na výrobu sú rozmanité a keďže sa podieľajú na toľkých rôznych procesoch, ťažko pomenovať určitý spúšťač. Celý systém lepšie pochopíme, keď ich budeme vnímať ako jeden z veľa regulátorov aktivity buniek, ako keby o jedno koliesko naviac na veľkom mixážnom pulte.
AKO ÚČINKUJÚ ENDOCANNABINOIDY?
Endocannabinoidy sú takzvané retrográdne transmitery, to znamená že ak si predstavíme komunikačnú reťaz nervových buniek ako dlhý kábel tak tieto látky spätnou väzbou ovplyvňujú a prevažne tlmia intenzitu, akou signály cez tento kábel prechádzajú. Inak povedané, ak kamarát na mňa hlasno kričí a ja mu gestom mojej ruky ukážem, že nech stlmí svoj rev a tým ho aj stlmí, tak spätná väzba prebehla porovnateľne, pričom v tomto príklade gesto mojej ruky je endocannabinoid vylúčený bunkou 2 a kamarátové oko, ktorým ho zbadá, CB-receptor bunky 1.
Takto sa endocannabinoidy nielen podieľajú na kognitívnych a pamäťových procesoch, fungovaní imúnneho systému a vývoji motorických schopností či celej bunkovej sústavy, ale aj výrazne ovplyvňujú pociťovanie bolesti, emočné a motivačné naladenie vrátane pociťovania strachu a depresie, plodnosť a tehotenstvo, či reguláciu chuti do jedla. Je badateľné, že endocannabinoidy sú dokonalo zakomponované do rozmanitých procesov v tele.
Najviac rozšírený receptor je CB1 (prvý popis 1990), nájdeme ho v tele prevažne na bunkách centrálnej (teda v mozgu a mieche) a periférnej nervovej sústavy (teda v nervoch zbytku tela a končatín), ale aj v zažívacom trakte, v srdci, v pľúcach, v močovom mechúri, v nadobličkách a na bunkách imúnneho systému.
Druhým hlavným receptorom je CB2 (prvý popis 1993), ktorý nájdeme predovšetkým na bunkách imúnneho systému, kde ovplyvňuje vylučovanie cytokínov, teda komunikačných a zápalových látok.
V bunke sa po viazaní na CB-receptory na jej povrchu aktivuje takzvaný G-proteín, bielkovina visiaca na vnútornej strane receptora, a spustí celú kaskádu aktivácie ďalších bielkovín. Koniec tohto reťazca väčšinou zahŕňa aj otvorenie kanálov v stene bunky pre kálium (draslík), čím sa výrazne stlmí signalizačná aktivita tejto bunky, ako keby sa troška pritlačila brzda. Susediace bunky možno majú iný receptor na cannabinoidy, alebo receptory na cannabinoidy vôbec nemajú, a práve tým vzniká profil účinkov.
PHYTOCANNABINOIDY
Využitie konopy poznáme už od starodávnych kultúr (ríša asýrčanov, skýtov, trákov a dáciov), kde prevažne šamani vyvolávali stav tranzu inhaláciou ich dymu. Stretáme sa ale už aj tu s konzumom na rekreačné účely.
Pri konzume konopy ako celej rastliny - či už prostredníctvom inhalácie alebo požitia ústami - v tele účinkujú všetky chemické zložky naraz. Keďže sú všetky cannabinoidy lipofilné (resp. dobre sa rozpúšťajú v tuku), rýchlo sa rozmiestnia po tele a po niekoľkohodinovej fáze hlavného účinku sa pomaly vylučujú pozostatky z tukových buniek. Najviac zastúpené sú cannabinoidy CBD (Cannabidiol) a THC (Tetrahydrocannabinol). Keď sa začala konopa využívať na medicínske účely, bolo veľmi dôležité presne zadefinovať, ktoré odrody obsahujú koľko množstva týchto chemikálií, a tak lekári napríklad v USA a v Nemecku majú k dispozícií rozmanitú paletu odrôd konopy s presne určeným pomerom týchto látok, aj keď sa ukázalo, že výdaj sušených častí rastlín podlieha u pacientov oveľa výraznejším variáciám koncentrácie ako výdaj olejových prípravkov s presnejšie realizovateľným dávkovaním. Taktiež sú dostupné tabletky s presne definovanými množstvami THC (napr. Dronabinol, Nabilon) a sprejove aplikátory (napr. Nabiximols obsahujúci THC a CBD).
THC (Tetrahydrocannabinol)
Povedzme si najprv niečo o THC (prvý krát popísaný 1964), keďže väčšina laických predstáv o účinkovaní konopy a jej prvkov spočíva z efektov práve tejto látky. Najväčšiu koncentráciu THC nájdeme v neoplodnených kvetinách ženského pohlavia. Po vstrebaní do krvi sa rýchlo rozmiestni po tele a silno viaže na receptory CB1 a CB2 a vyvoláva takto svoje účinky ako pocit uvoľnenia a redukcie bolesti, ale aj pocit šťastia a ďalšie psychoaktívne efekty (byť „high“), ktoré majú potenciál vyvolať závislosť a pri náchylných osobách, alebo vysokom dávkovaní, môžu prejsť do pocitov strachu a paranoje, zmeny vnímania zmyslových vnemov a v krajných prípadoch aj utlmení dýchania. V tomto súvise sa vyskytli aj úmrtia.
V medicíne sa využíva na tlmenie silných neuropatických alebo onkologických bolestí, na zmiernenie zvýšeného svalového napätia (spasticity) v rámci neurologického ochorenia skleróza multiplex, proti nevoľnosti a zvracaniu v súvislosti s chemoterapiou a na podporu pocitu hladu v rámci HIV/ AIDS. Ako vedľajšie účinky dávok používaných v medicíne poznáme najmä únavu, závrat, nevoľnosť, rýchly pulz, zmeny krvného tlaku, sucho v ústach, bolesť hlavy, ale aj vplyvy na psychiku (vrátane zvýšenej konzumácie jedla) a pri vyššom dávkovaní ľahké psychotropné efekty.
CBD (Cannabidiol)
CBD (prvý krát popísaný 1940) sa na rozdiel od THC viaže CB-receptory iba pomerne slabo a k tomu ešte aj tak, že ich síce obsadí a zablokuje, ale nevyvolá očakávaný efekt (takáto látka sa nazýva antagonist). Takto pôsobí protichodne k niektorým účinkom THC a z pohľadu farmakológie akoby zmierni niektoré z jeho nežiadúcich účinkov (najmä psychoaktívne efekty a zrýchlenie pulzu).
CBD sa dodatočne viaže na CB1-receptor aj mimo hlavnej „pristávacej plošiny“ s podobným tlmivým efektom a taktiež sa viaže na iné receptory rôznych molekulárnych odvetví, napr. aj zo skupiny vaniloidov ako je capsaicin, štipľavá zložka čili papriky, aj zo skupiny receptorov pre serotonín, ktorého aktivita v mozgu sa spája so stabilizáciou nálady a pocitom šťastia no aj s výskytom návykových ochorení. Taktiež za určitých okolností vie priamo ovplyvňovať funkčnosť mitochondrií, malých častíc bunky na výrobu energie. Týmto vzniká takzvaný „entourage effect“, čo vykresľuje podstatu, že účinok je veľmi komplexný a ťažko uchopiteľný.
Od CBD nepoznáme zatiaľ žiadne psychotropné príznaky otrávenia, ako napríklad od THC, ale pri vyššom dávkovaní sa takisto stretneme s únavou, nevoľnosťou, u niektorých osobách s pocitom vnútorného nepokoja, s ťažkosťami zaspať a zníženou chuťou do jedla.
Treba poznamenať, že orálna bioaktivita CBD je len 6 %, to znamená že po požití ústami sa iba malé množstvo dostane do krvi a dosiahnutie maximálneho efektu môže trvať 1-2 hodiny. Inhaláciou sa dosahuje bioaktivita okolo 30 % s nástupom maximalneho efektu behom pár minút. Po výdatnom molekulárnom spracovaní v pečeni a v črevách sa vylučujú odpadové produkty močom, polčas vylučovania v tele je zhruba 20-30 hodín (teda čas, za ktorý sa vylúči polovica vstrebaného množstva). Treba ale myslieť na už spomínané pomalé vylučovanie z tukových buniek. (Pre tých, čo sa zaujímajú, pri THC sa tento čas pohybuje okolo 50 hodín a jeho metabolity nachádzame v moči niekoľko dní, najmä pri pravidelnej konzumácii.)
Na lekársky predpis sa používa ako dodatočná terapia pri ťažkých epileptických ochoreniach, zatiaľ u prevažne pediatrických pacientoch (syndrómy Lennox-Gastaut, Dravet a tuberózna skleróza). Konkluzívne štúdie existujú pre pacientov so sklerózou multiplex, keď trpia neuropatickými bolesťami, poruchami spánku alebo spasticitou. Anekdoticky popísané účinky napríklad na migrénu, schizofréniu, úzkostné poruchy, závislosť na THC, Tourettov syndróm, Huntingtonovu alebo Parkinsonovu chorobu sa často v rámci dôkladnejších klinických štúdií nedarí napodobniť, aj keď niektorí pacienti hlásia, že sa subjektívne cítia lepšie.
V prípade CBD bolo do roka 2021 nakoncipovaných vyše 400 takýchto štúdií, z toho ukončených zhruba polovica. Aj keď výskumné úsilie smeruje aktuálne rôznymi smermi, a v rámci niektorých laboratórnych pokusov získavame zaujímavé poznatky, americká štátna agentúra na kontrolu liečiv (FDA - Food and Drug Administration) každý rok karhá predávajúcich kvôli zradným a klamlivým tvrdeniam o zatiaľ nedostatočne vedecky podložených zovšeobecneniach a hypoteticky diskutovaných vplyvoch na rakovinu, autizmus alebo demenciu.
AUTOR: Dr. Marian Šujak, neurológ pôsobiaci na klinike v Rakúsku
ZDROJE:
- Bruni et al. Molecules 2018
- Devane et al. Science 1992 - prvý popis endocannabinoidu AEA
- Devinsky et al. Epilepsia 2014
- Herodotus Historie - využitie konope v staroveku
- Hillard C Neuropsychopharmacology 2018
- Huestis Chem Biodivers 2007
- Laprairie et al. Brit J Pharmacol 2015
- Lucas et al. Brit J Clin Pharmacol 2018
- Mechoulam et al. J Clin Phramacol 2002
- Mouslech & Valla Neuro Endocrinol Lett. 2009
- Olivas-Aguirre et al. Cell Death & Disease 2019
- Pertwee R Endocannabinoids - Handbook of Experimental Pharmacology, Springer 2015
- Prospéro-García O Arch Med Res 2019
- Scuderi et al. Phytotherapy Research 2009
OBRÁZKY:
- Guryanov et al. Materials Science & Engineering 2016
